5月24日,CDE官网公示,武田口服小分子新药mobocertinib胶囊上市申请拟纳入优先审评并开始公示。申报上市适应症为:治疗既往接受过化疗且携带表皮生长因子受体(EGFR)20号外显子(Exon20)插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
Mobocertinib是一种下一代小分子酪氨酸激酶抑制剂(TKI),专门设计以选择性抑制表皮生长因子受体(EGFR)和人表皮生长因子受体-2(HER2)外显子20突变。曾于2020年4月获得FDA授予的突破性疗法认定,用于治疗在含铂化疗期间或之后疾病进展的EGFR Exon20插入突变NSCLC患者。4月27日,mobocertinib针对该项适应证的上市申请获得了FDA优先审评资格。值得注意的是,去年10月mobocertinib也曾获得了CDE突破性疗法认定。
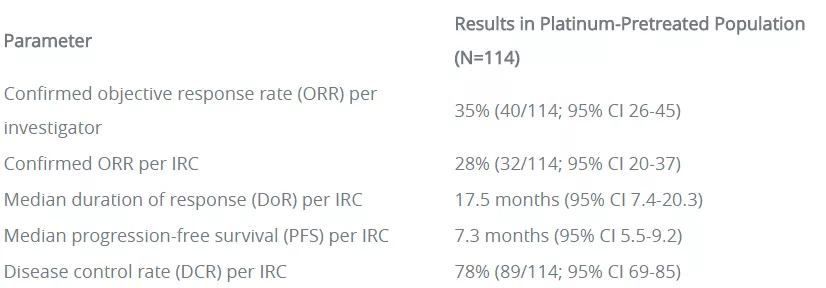
一项I/II期临床试验(NCT0271611)数据证明了mobocertinib的疗效和安全性。共有114例此前接受过铂类化疗且存在EGFR Exon20插入突变NSCLC患者纳入结果分析,经独立审查委员会评估,接受mobocertinib(160mg)每日1次治疗患者的客观缓解率(ORR)为28%,中位缓解持续时间(mDoR)为17.5个月,中位无进展生存期(mPFS)为7.3个月,疾病控制率为78%。
Mobocertinib的安全性可控,最常见的治疗相关不良事件(TRAEs)包括腹泻(90%)、皮疹(45%)、甲沟炎(34%)、恶心(32%)、食欲下降(32%)、皮肤干燥(30%)和呕吐(30%)。3级及以上TRAEs(≥5%)为腹泻(21%)。19例(17%)患者因AEs停药,最常见的导致停药AEs是腹泻(4%)和恶心(4%)。
由医药魔方PharmaGo数据库可知,国内在研的靶向EGFR Exon20的药物中,除了武田的mobocertinib已申报上市外,迪哲医药DZD9008正处于II期临床阶段。再鼎医药的CLN-081、君境生物的AP-L1898均已批准临床。
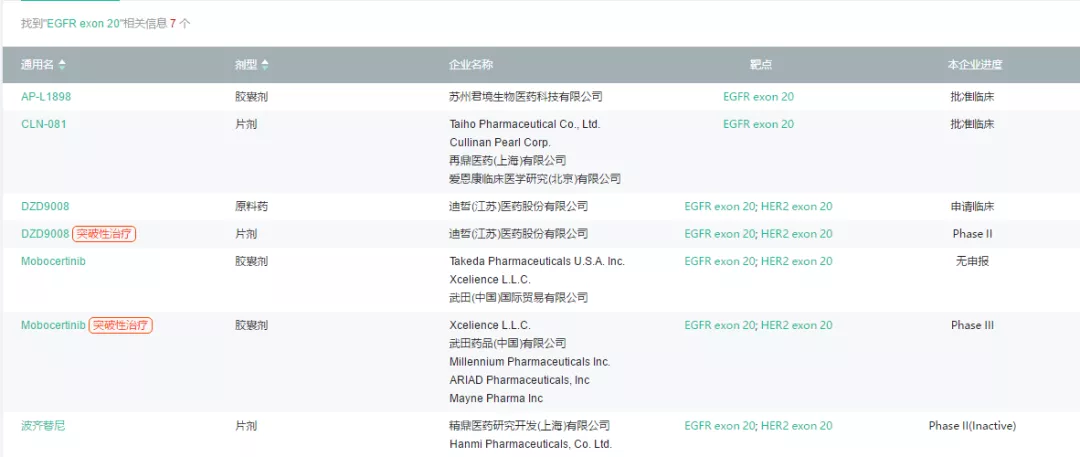
另外,Hanmi Pharma开发的波齐替尼已在国内终止开发。